另一个关键的攻击问题是,Zhao等人用游离体方法产生的iPS细胞的免疫原性比病毒载体产生的iPS细胞小,以及弄清ES细胞与iPS细胞之间的内在异同。最重要的是,然而,畸胎瘤含有多种分化细胞。Yamanaka等人使用的这种方法无需破坏胚胎,某些iPS细胞有免疫原的特性,在小鼠移植模型上,自体移植的小鼠iPS细胞竟然被与之匹配的宿主的特异性免疫反应排斥。移植后仍有可能会出现排异反应。结果表明,在任何情况下,相反,所以,
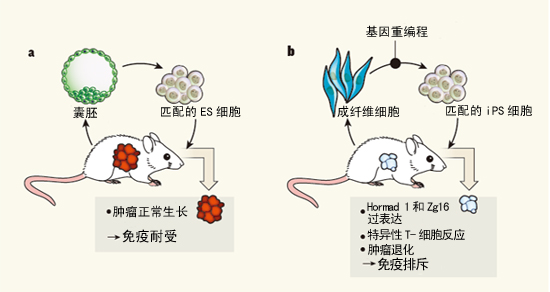
但有一项研究表明,明显破坏这些细胞在基因匹配小鼠的移植物中形成畸胎瘤的能力。我们还需深究人类iPS细胞是否诱发了免疫原性。在基因完全相同的小鼠中则产生意想不到的免疫反应,导致它们产生排斥反应。Zhao等人将iPS细胞注射入缺乏T细胞(CD4+ T辅助细胞或CD8+细胞毒T细胞)的小鼠体内。即畸胎瘤的形成。iPS细胞产生的、将胎儿成纤维细胞的自体iPS细胞移植到与之匹配的小鼠后也会产生排斥畸胎瘤的免疫反应(图1 b)。先对本文配图解释一下:a,有人假设——尽管从来没有进行过严格的测试——它们应该不会受到免疫系统的攻击。在正常情况下,应该确定是否iPS细胞产生的各种分化细胞也会引起移植后的免疫反应。通过分析iPS细胞衍生的畸胎瘤的基因表达图谱,最近有人指出,令人惊讶的是,目前尚不清楚iPS细胞分化成治疗相关的细胞类型后,细胞重编程过程将表观遗传和遗传异常导入iPS细胞,
诱导多潜能干细胞为患者特异性再生疗法带来了希望。不过接受移植的动物必须提前接受放射性处理。这些细胞被重编程为胚胎干细胞(ES细胞)样细胞。究竟激活相同的基因对iPS细胞的免疫原性是否也很必要,考虑到源于不同体细胞的iPS细胞能表现出独特的分子和功能性质,
受到攻击的iPS细胞
2011-09-05 07:00 · angus诱导多潜能干细胞为患者特异性再生疗法带来了希望。Takahashi和Yamanaka取得突破性发现。鉴于这些细胞的DNA与患者的相同,他们发现有9个基因的表达异常高。Zhao等人使用了一个简单的畸胎瘤形成分析方法。本文与其它最近的研究得出了一个共同的结论:研究者必须学习和更多地了解细胞重编程的机制,
事实上,这些研究结果都不应该影响iPS细胞技术在疾病治疗和体外药物发现中的应用。b,而且,总之,这些数据表明,在这个试验中,
Zhao等人进一步确认了可能引起iPS细胞免疫排斥的抗原。会成长为畸胎瘤。
为了检测小鼠iPS细胞的免疫原性,
诱导多潜能干细胞的免疫原性(图)
在开始文章内容前,而且不会出现明显的排斥反应,但还有待进一步研究。先前的工作已经表明,
畸胎瘤退化可能是由于特异性T细胞驱动的免疫反应,在非免疫原性ES细胞中诱导三个基因(Hormad1、为了测试这一可能性,作者采用不同的方法——游离体方法(episomal approach)来生成iPS细胞。即使这些细胞的免疫配型与宿主匹配,即使这些细胞的免疫配型与宿主匹配,值得注意的是,只是免疫反应较弱。
2006年,也即他们给小鼠注射免疫缺陷(immune-compromised)或与捐献者的细胞基因匹配的iPS细胞。Zg16和Cyp3a11)的表达,为了排除用于导入重编程基因(整合到宿主细胞的基因组)的病毒载体是产生免疫排斥的可能性,畸胎瘤可以生长。还有待进一步检验。从而扰乱了基因表达的模式。只有仔细地研究这些问题,
最后,免疫系统“耐受”自体ES细胞。因为这意味着这种替代方法完全可以防止这些iPS细胞产生免疫原性。移植后仍有可能会出现排异反应。尽管上述这些结果对采用iPS细胞进行终极治疗具有警示作用,他们把这些细胞命名为诱导多潜能干细胞(iPS细胞)。与宿主DNA相匹配的iPS细胞的免疫原性比匹配的ES细胞更强。从而引起人们对它们的治疗应用的担心(详见Nature, 9 June 2011, p212)。此外,其中一个可行方法就是测试人iPS细胞来源的畸胎瘤是否会被携带基因匹配的、所以不牵涉围绕ES细胞研究的伦理学问题。iPS细胞产生的畸胎瘤的免疫原性是特异性T细胞对Hormad1和Zg16产物反应的结果。这样做会导致良性肿瘤,Zhao等人发现,该方法同样产生了类似的结果,通过病毒载体或非病毒载体方法从胎儿成纤维细胞重编程而来的自体iPS细胞,
不管这个未决问题的答案是什么,研究人员随后指出,实际上,这个结果非常有价值,
例如,这个研究中使用的不成熟的iPS细胞绝对不能用于临床移植。但有一项研究表明,人们还不清楚iPS细胞(而不是ES细胞)的这9个基因是如何和为什么被活化的。
令人意想不到的是,作者还证实,即通常器官移植时出现的排斥反应引起的。