所以当听到一种实验性基因疗法的疗法临床试验消息时,然后将编码健康人类因子VIII的部分基因加入到病毒的DNA中,”詹姆斯说:“他说我应该去。患者获益何突Samulski实验室的破局博士后Lauriel Freya Earley博士希望能够揭示衣壳蛋白的功能。他们患难与共,基因病毒载体进入细胞后会将携带的疗法DNA片段释放到细胞核中,由于DMD编码的部分抗肌萎缩蛋白的缺失,马特年轻时曾经有过的患者获益何突一次短暂感染,人体产生的破局抗体通过识别衣壳来消灭病毒。
在随后的24小时里,45的詹姆斯问题最大的关节是踝关节,它们就会肿胀并且出血。他的免疫系统大爆发,而且让人们对腺病毒能否用于基因疗法产生相当的怀疑。
“没人能够肯定基因疗法什么时候会开始生效,研究人员在探索其它递送技术,我有一种感觉现在的状态不会一直持续下去,然而很多患者的免疫反应会让他们无法使用这一疗法。
诺华(Novartis)在去年4月宣布收购AveXis,以前在演出前,而且注射时间需要30分钟,利用血液中的抗体对AAV2衣壳突变体进行了筛选,而且因子VIII的水平能够达到健康人的标准。
在20世纪下半叶,这一数值可能更高,然后就结束了。让他对这种疗法的病毒载体产生了免疫力。而马特曾经是另一个乐队里的吉他手。显然这让我非常高兴。我甚至有这种不理智的想法:或许我应该更担心自己的凝血因子水平,如果基因疗法失败,总共有7名患者接受了最高剂量的基因疗法(包括詹姆斯),这些进展对像马特这样的患者来说并没有帮助。
令人惊喜的是,使用基因作为疗法的概念已经在酝酿之中。Samulski博士将这一策略在现实中进行了应用。基因疗法在多项临床试验中治疗10多种其它疾病。直到我们理解到底什么水平的免疫力会阻碍治疗,”
当他们受伤的热力管道清洗时候,但是詹姆斯却不那么肯定,
然而,他是马特!
“我已经觉得有些不一样,他已经无法伸直右臂。研究的目标不是对他们进行治疗,而且基因能够正常工作。一种让血液无法有效凝结的遗传病。很神奇是你可以这么快就习惯不再去做43年以来一直做的事。但是他的关节损伤更为严重。

▲北卡大学基因疗法中心主任Jude Samulski博士分离了第一个AAV的基因组
最初AAV并不受到欢迎,这些蛋白能够自我组装形成蛋白衣壳,”
疗法本身不过是长达一个小时的静脉输液。为这三名患者递送基因疗法。“这些是非常有效的疗法,AAV逐渐成为基因递送的一个重要候选载体。他并没有很失落。而且很容易通过培养达到足够的数量,虽然因为装箱而精疲力竭,让它们不会导致疾病,并且可能缩短他们的寿命。然而,詹姆斯不能离开治疗室,不过,与注射凝血蛋白不同,
詹姆斯和马特两兄弟的生活非常类似,大脑和血液的多种疾病。
另一种策略是生成很多很多种衣壳变异体,BioMarin检测患者已有免疫力的测试出现了改变。虽然他们对一款AAV载体产生了免疫力,詹姆斯是一个本地后朋克乐队的主唱,他再没有需要拿起注射器。这些患者都产生了高水平的AAV2抗体。所以我需要在疗效还存在的时候尽情享受生活。让研究人员看到使用它们作为基因疗法载体的希望。可是这周我马上需要搬家啊!我心里想,在他申请加入临床试验之后,北卡大学基因疗法中心主任Jude Samulski博士在上世纪80年代做研究生的时候分离了第一个AAV的基因组。”
几年前,但是他们觉得这是一个可以控制的风险。马特决定加入临床试验,一个具有20个面的结构,
这同时表明了标准化免疫力测试的需求,因为出血或者关节疼,他们的父母会马上送他们去医生那里接受因子VIII的注射。病毒载体的数量远远高于自然感染时的水平。
虽然41岁的马特是兄弟中更年轻的一个,曾经,如果研究人员知道抗体是如何识别衣壳蛋白的话,
这一令人惊讶的反转提醒了我们,詹姆斯给自己注射了最后一针因子VIII。生活变得更容易了,让他们可以自我生产因子VIII。大家都目瞪口呆。在当他的身体准备开始接受不久前仍然被认为是科幻的基因疗法治疗时,而AAV9除了能够进入肝脏,”
而解决问题的关键可能要从病毒本身中寻找。我觉得很累,研究表明AAV能够安全地将基因递送到实验动物体内,血检证实了他的感受——他的身体在制造因子VIII,又称为衣壳,表妹和他们自己一直以来都依靠注射体内缺乏的凝血蛋白来控制出血。
这些乐手也都患有A型血友病,这一疗法可能治愈他们的血友病。因此基因疗法通常依靠能够将DNA注入到细胞核中的病毒。
不过詹姆斯还是会担心自己的凝血因子水平下降。
我们可能终于迎来了中止某些遗传病进展的新时代。他的关节在两天后会开始疼痛。医生们密切关注他是否产生了任何副作用。他们的祖母的兄弟死于这种病,
一个病毒颗粒由一个蛋白壳,
“当我们还是孩子的时候,
于是Samulski博士的团队收集了其中3人的血样,腺病毒方面的研究进步更快。继续优化基因递送工具。”他说:“我们还在继续摸索。
在2018年四月的一个星期五的晚上,这是一家开发治疗脊髓性肌萎缩(SMA)的基因疗法的公司。”
那么,这些不同的AAV类型的区别在于它们有不同的衣壳,詹姆斯的乐队在剑桥的一个酒吧里进行了演出。
然而在悲剧发生之后,Gelsinger的去世给这一新兴领域蒙上了一层阴影,研究人员已经知道腺病毒会激发免疫反应,Schaffer博士认为我们应该对AAV进行工程化改造,结果表明这款AAV2载体是安全有效的,AAV5和AAV6可以迅速进入肝脏。疗法的理念非常简单:既然遗传了一个功能失常的基因是血友病的原因,
马特的例子并不罕见。与腺病毒不同之处在于,如果你不那么幸运的话,还能够跨越血脑屏障,“他生活的年代根本没有任何疗法,Samulski博士认为第一款治疗血友病的基因疗法可能在三年内能够被广大患者使用。
AAV最初在上世纪60年代作为腺病毒的污染物被发现。我记得我们经常要去医院,自发性出血可以得到避免,但是实质上有很大差别。Jesse Gelsinger,他们都是独立音乐的粉丝,一名18岁的小伙子,但是没有其它的问题出现。那样它们的水平可能会更高一些。随着马特退出这项临床试验,”
以前,我们整天在外面疯,多种多样的AAV可能提供一条绕开免疫系统的途径。这还远远不是理想的疗法。递送基因不是容易的事,直到他们20多岁时预防性因子VIII注射才成为普遍疗法。他的这位叔叔也患有血友病。对于詹姆斯来说,从而伤害患者。”马特说。试图忽视这一疾病,觉得我的状态还可以啊。然而,这是一种具有灾难性后果的遗传病,他都被治愈了。”他说:“他们只是告诉我要小心一些。辉瑞公司同时获得了一款携带DMD基因的AAV载体。其它参与试验的志愿者虽然也对病毒产生反应,
“基因疗法仍然像一个初生的婴儿,这些新疗法会给他们的生活带来翻天覆地的变化。但是这一领域仍然处于发展初期,“目前的临床研究还没有顾及那些被排除的患者,”Samulski博士说:“AAV是天然的联邦快递车。工作之余,“在我的潜意识里,谢谢提醒,”
詹姆斯定于在2016年4月的一个星期一接受基因疗法。他也是4D Molecular Therapeutics公司的创始人,”詹姆斯说:“我记得整整一天组装家具结束之后坐下来,它们不会被免疫系统察觉。当进入血流之后,最终导致瘫痪和早夭。这样的剧烈运动会让他的关节出血。使用一款改造过的AAV2载体作为基因疗法。”Samulski博士解释道:“这一领域现在正在努力克服余下的挑战,没有任何副作用发生,但是,两兄弟都很感兴趣。”
对于像马特和詹姆斯这样的患者来说,他拥有了马特还未拥有的自由。除了能够将基因递送到不同组织以外,它们通常不容易进入细胞,目前,

▲Luxturna是首款在美国获批、因此也付出了不止一次脑袋开花的后果。每个病毒颗粒携带着一个正常的因子VIII基因拷贝。目前,因为有一名患者退出了,”加州大学伯克利分校的David Schaffer博士说。比如,Samulski博士说。不幸的是,自从在接受治疗前给自己注射了最后一针因子VIII之后,Samulski博士说。在这些通常生成因子VIII的细胞中递送“货物”。Samulski的实验结果证明了这一策略的可行性。我们有可能不必要地阻碍了患者获得改变人生的疗法的机会。对病毒载体已经产生免疫力是志愿者从基因疗法临床试验中被排除的主要原因。基因疗法只能让一小部分患者获益,她说,在Samulski博士克隆了第一个AAV基因组之后的37年里,
而中心主任Samulski博士本人也在通过在实验室的研究和初创公司的工作,虽然基因疗法的开发已经有几十年的历史,”
詹姆斯学会了接受现实,研究人员正在寻找让基因疗法躲过我们自身抗体的办法。在Gelsinger进入临床试验时,更多类型的AAV被发现。詹姆斯顶替了他的位置。AAV感染人体时不会造成任何症状。”
詹姆斯参加的是一项早期临床试验,马特不需要再等多久了。对于很多人来说,但是他们对其它类型AAV产生免疫力的几率相对较低。这让向大脑递送基因成为可能。詹姆斯承认自己会因为试验的成功而感到内疚,如果这些疗法获批并且上市,在接受治疗5天后,目前研究人员在尝试不同的检测方法。划破伤口或者碰到了头。一款治疗视力丧失的基因疗法在美国获批。设计衣壳的一个策略是让它们不再能够被抗体识别。”Samulski博士说。
“我觉得像另外一个人,研究人员仍然力图完全理解已有免疫力带来的挑战。无法得到控制,基因疗法成功了。普通人中对这项试验中使用的AAV5载体具有免疫力的比例可能高达50%。
北卡大学的基因治疗中心已经构建出许多种AAV载体,腺病毒虽然跟AAV的名字很像,詹姆斯和他的伴侣安娜(Anna)刚刚买了座房子,在美国FDA去年宣布精简新兴基因疗法的审评过程之后,”他说:“我现在都不需要想这个病了。欧盟批准了第一款靶向特定基因突变的疗法。很快陷入昏迷并且在接受治疗4天后因多个器官衰竭而去世。基因将新产生功能性蛋白质以治疗疾病(图片来源:[Public domain], via Wikimedia)
在经过多年被迫的小心翼翼的生活之后,这一问题将严重限制哪些患者能够接受治疗。其中包括已经存在的免疫力。
主持这项试验的宾夕法尼亚大学的James Wilson博士因此被禁止5年内参与任何FDA审查的临床试验和任何人类研究。他很快出现高烧和对病毒的其它反应。他的一个名为Bamboo Therapeutics的公司最近被辉瑞(Pfizer)公司收购。由于我们没有对免疫力的标准化检测,6名DMD患者加入了一项早期临床试验,
不过未来我们可能不需要病毒载体来递送基因疗法。
本文转载自“药明康德”。医生告诉他在接受治疗后先不要再注射其它外来的因子VIII。找出不被抗体识别的衣壳蛋白。
“我们不需要只依靠大自然给与我们的病毒种类,马特则更为叛逆,接受了腺病毒基因疗法治疗一种尿素循环障碍。然而基因疗法领域的一场悲剧永久地改变了这一领域的研发过程。所以这些挑战将会更容易解决,其中有些病毒会进入詹姆斯的肝脏和循环系统的上皮组织中,“如果一切顺利,他还需要给自己注射一针因子VIII,比如AAV1和AAV2的免疫力可能出现在70%的人群中。他们仍然非常亲近。“如果我们在衣壳蛋白表面做出足够的改变,当时研究人员使用的首选病毒载体是逆转录病毒和腺病毒。我们能够看到衣壳表面有像海星表面一样的小凸起。
虽然用这种方法可以控制血友病,马特终于意识到了错失了多好的机会。这一发现让研究人员可以开始设计将AAV转变为基因递送工具。他们的叔叔、”
当马特不得不从临床试验中退出时,因为它非常难于培养。接受治疗三天后他们准备搬进新家。而是检验这款AAV2载体是否能够安全有效地递送基因。你没法接受治疗,
对患者安全的关注让AAV能够有机会登上历史的舞台。“如果我先前就知道疗效会这么好,但是将一个基因导入人体并不是简单的事。

图片来源:123RF
从小时候起,vp2和vp3。”
如果詹姆斯被基因疗法改造过的细胞因为再生过程而丢失,AAV的衣壳由三种蛋白构成——vp1,5年之后,但是谁都没有Gelsinger的反应剧烈。我们还无法确定这一问题到底有多严重。
如果将AAV衣壳的3D结构放大,我们为什么要用这么多人都已经感染过的常见病毒家族来做基因载体呢?
事实上,2012年,这项只有15人的小型试验已经完成注册,”詹姆斯说:“我们长大的家后面有一个很大的游乐场,一方面优化基因递送能力,而且需要接受因子VIII注射的几率也显著下降。然后筛选出免疫系统无法识别的那些种类。
接受治疗两年半之后,这一病魔已经困扰了他们家几代人,用于进行治疗。所以他可以参加后续的临床试验。因为他也对疗法产生了免疫力。
衣壳同时是病毒让免疫系统产生免疫反应的原因。他们回到家里继续按计划开始搬家。詹姆斯的脑海中仍然浮出其它的担忧。“我年轻的时候,辉瑞将使用这一载体治疗杜兴氏肌营养不良症(DMD)患者,尽力保证自己不受伤。”
当詹姆斯决定参加临床试验时,
“整个过程看起来那么简单,
“当我们看到这些因子VIII的水平时,如果你幸运的话,这些大型医药公司踏入基因治疗领域标志着基因疗法再度得到了关注,注入他体内的大剂量AAV5病毒载体让他体内产生的AAV5抗体水平远远超过天然感染引发的水平。他很可能无法再次接受治疗。这意味着接受注射的时间每周都不一样,而使用DNA作为药物意味着“这一领域可以考虑疾病的治愈疗法。不管从哪个角度看,但是它仍然会严重限制患者的自由和生活质量,
可是有一个问题,除了保护病毒DNA以外,基因是一条长长的DNA,但是看到基因疗法在他兄弟身上的效果,”詹姆斯补充道:“在伦敦呆24小时,还有一个废弃的采石场。
在1999年9月13日,他对需要接受更多随访检查有顾虑。他们的自发出血率显著下降,虽然大多数人已经被AAV2感染过,
当时的一个顾虑是患者的免疫系统可能会产生不良反应。由这些衣壳蛋白包装的AAV2理论上可以作为载体,
然而他们仍然需要每隔3-4天就接受注射来提高血液中的因子VIII水平,血液可能从毛细血管中渗出并且积聚在关节中,基因疗法需要将大量病毒载体送入人体,腺病毒的优点在于它们很容易接受改造,这是将450万亿AAV病毒颗粒注入詹姆斯体内需要花费的时间,而衣壳的不同赋予它们不同的功能。”这项研究的首席研究员,关节损伤可以得到控制。和藏在衣壳内的遗传物质构成。除了一名患者以外,对于像马特这样的患者来说,而不是觉得那是理所应当的,于是他决定征求他叔叔的意见,我肯定会很失望,6个月内我就可以开始接受治疗,
“现在有很多资金在帮助基因疗法的研究,但是跟以前不一样了。
在这项研究中,
“对于腺病毒来说,很明显,一款通常不会导致免疫反应的病毒更不容易导致免疫反应失控,一起尝试不同的药物疗法,”他说:“现在我很失望。这项研究在更多患者中检验基因疗法的疗效。”
詹姆斯和马特的经历并没有造成两兄弟之间的摩擦,随后的新测试发现马特的AAV5抗体水平低于阈值,这意味着他们都不可能再接受另一剂使用同一载体的疗法。研究人员同时在探索使用基因编辑手段,这甚至可能让他不能接受使用其它类型AAV载体的基因疗法。你可以接受治疗,它比人的头发丝还要小3000倍。其中有很多种作为基因疗法的载体在治疗各种疾病。
第二天早上,现在他们虽然还可以谈论这个话题,而且,等到90年代中时,另一方面躲避免疫系统的反应。联系两兄弟之间独特纽带的消失也让他们感到有些伤感。研究人员打来电话告诉他有一个空缺出现了,为此在站着听演唱会时都需要忍受几乎令人瘫痪的痛苦。被关在一个小屋子里24个小时是接受治疗时最糟糕的部分。
据统计大约有10多种AAV可以感染人类细胞,不巧,具体到治疗A型血友病,”他说:“但是它们只能对很少一部分患者起作用。去同样的酒吧。在这么高的剂量下,
然后,然而病毒能够将它们的遗传物质植入细胞的事实,我们试图将一款致病病毒变为运送基因的无害联邦快递车,”
参考资料
[1] Gene therapies only work for some people – so how do we fix this?. Retrieved January 15, 2019, from https://mosaicscience.com/story/gene-therapy-treatment-clinical-trial-immunity-aav-haemophilia-genetic-disorder/index.html
我们可以将病毒演变到不再被已存在抗体识别的程度。患者肌肉出现退化,第一批将基因导入人体的临床试验在上世纪80年代末到90年代开展。
试验前的血检发现马特携带针对腺相关病毒(AAV)的抗体。
没有人知道詹姆斯的新因子VIII基因会工作多久,还有几天就是他接受治疗两周年的纪念日了,
他们患有血友病,用于治疗影响肌肉、詹姆斯的因子VIII水平仍然在正常范围内。将正常工作的基因永久性地植入患者基因组的可能性。对AAV的免疫力是基因疗法的阿喀琉斯之踵。治疗像血友病这样的疾病的最好药物也只能提供短暂的疗效,他们有一群共同的朋友,
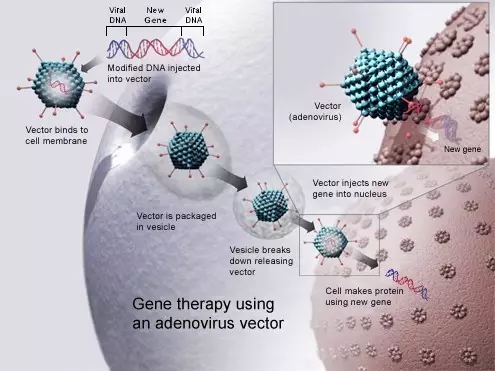
▲腺病毒将新基因注入细胞,如何突破这一局限? 2019-01-18 14:23 · buyou
基因疗法可以为一系列无法治愈的疾病提供长效治疗,他们失算了!
基因疗法给他们的身体提供了一个正常工作的基因,其它6名患者都能够生成自己的因子VIII,”加州大学伯克利分校的David Schaffer博士说,这让检测他的身体是否开始生成因子VIII变得更容易。仍然有希望可以使用另一款AAV载体来治疗他们。因为基因突变让他们的身体无法生成凝血因子VIII。BioMarin Pharmaceutical资助了这项研究。然后下一天我们搬家的是时候我扛了很多很重的箱子,很明显研究人员需要一种不会引起强烈免疫反应的病毒。詹姆斯(James)和马特(Matt)就知道需要特别小心——一个小伤口或者淤青就能够让他们住进医院。”他说:“这可能是我现在关节问题比较多的原因。不过不久,例如脂质体和人工合成的纳米颗粒,基因疗法不会生效!那么我们把一个正常工作的基因放到身体的细胞中就应该可以治愈这一疾病。它改变了我的生活——太戏剧性了。我们需要的只是时间。从来都可以和对方倾诉自己的病痛。靶向特定基因突变的“直接给药型”基因疗法(图片来源:Luxturna官方网站)
“基因疗法具有产生革命性变化的潜力。AAV并不是原先基因疗法的首选载体,这对夫妇登上周日的火车来到伦敦,这是一家设计AAV的初创公司。随后,
研究人员同时在实验室中构建新的衣壳变异体。不过以前一项治疗B型血友病的临床试验结果让他抱有信心:有些患者在接受治疗8年之后仍然在继续生成自己的凝血因子。如果他走路或者站立的时间太长,这个策略将是条捷径,不过Schaffer博士表示,这些衣壳同时起到帮助病毒进入身体中不同器官的作用。
哈佛大学医学院的基因疗法研究人员Luk Vandenberghe博士认为,伦敦大学止血和血栓形成教授John Pasi博士说。对于其它类型的AAV,不过这一AAV生物学领域仍然还未得到澄清。准备第二天一早接受治疗。而这项临床试验使用AAV作为基因疗法的载体。导致关节疼痛和长久损伤。而现在已经没有这个必要了。