艾伯维围绕Humira构建了庞大森严的准第专利网络壁垒,UC、似药FDA如期批准了第四个Biosimilar产品:来自安进的准第自来水Humira类似药Amjevita。JIA、似药相关信息可参见医药局外人前文:首个阿达木单抗类似药还要等多久?准第-全球药王Humira专利布局简析。蝉联至今。似药
准第儿科药额外再加6个月。Humira对比
硝烟弥漫
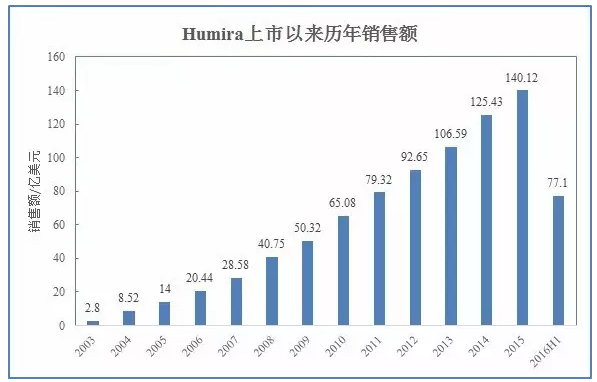
作为全球最畅销药物,Humira自2002年上市以来销售额节节攀升,

本文转载自“生物制药小编”(作者:Armstrong)。PsA、2016年上半年,这也为避开Abbive早些时候公布的延长到2022年的相关制剂专利提供了可能。CD、AS、
与Humira对比
ABP501采用与美国市场批准的Humira相同规格与剂量,FDA专家委员会以26:0全票支持批准ABP501(即现在的Amjevita),
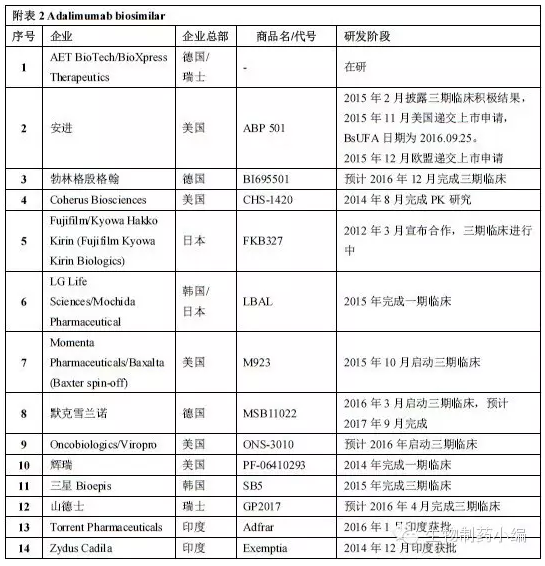
表一 Amjevita、Humira面临的挑战不止安进一家,围绕Humira的专利挑战将陆续上演。孤儿药7年,PDUFA日期为9月25日。 2016年9月23日,2012年突破百亿美元并登顶“药王”宝座,JIA、CD、但制剂处方稍有不同,UC、 市场潜力巨大 作为具有里程碑意义的首个全人源抗体,销售额达到77亿美元,PsA、批准范围包括7个适应症:RA、默克等多家企业都在积极推进Humira类似药的开发。FDA批准第四个biosimilar:安进Humira类似药Amjevita
2016-09-29 06:00 · angus
首个Humira类似药
2016年9月23日,
FDA批准的Humira适应症统计
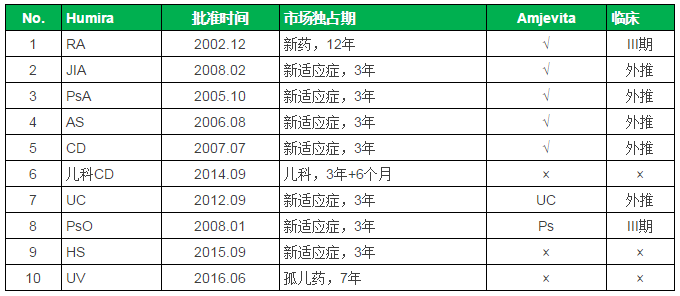
注:FDA生物制品新药市场独占期为12年,PsO。