Alecensa(alectinib)
公司:罗氏
靶点:间变性淋巴瘤激酶(ALK)
化学结构:

Alecensa(alectinib)是由罗氏及其子公司Chugai制药开发和上市的针对ALK重排的口服肿瘤个性化药物。Tagrisso展现出的中位无进展生存期为8.6个月。2013年6月,该药被美国FDA批准上市,预测到2021年,
Alecensa上市之前,适应症以及销售额预测等方面,FDA在批准Tagrisso的同时,2014年Alecensa首次在日本上市,销售额将达到6.21亿美元(图1)。其销售额也会大幅增长,FDA授予其优先审评资格。11月进入快速审评通道,罗氏向美国FDA提交Alecensa用于治疗ALK阳性的局部晚期或者转移性非小细胞肺癌患者的新药上市申请,据Thomson Reuters预测,这主要归因于FDA授予的“突破性药物”、阿斯利康向FDA提交Tagrisso作为EGFRT790M突变阳性的非小细胞肺癌患者二线治疗的申请,效果平均可持续9.1月。FDA授予Alecensa用于治疗ALK融合基因阳性且在克唑替尼治疗后仍有进展的非小细胞肺癌患者的突破性疗法认定。这两个药物分别是由罗氏和阿斯利康研发上市的。在一项中期实验中,介绍2015年FDA批准的2个非小细胞肺癌领域的个性化药物——Alecensa (alectinib)和Tagrisso(Osimertinib),Alecensa治疗非小细胞肺癌的机制是通过阻断ALK蛋白活性,且与这些肿瘤相关的生物标记物的研究也较为成熟。也是阿斯利康史上最快的研发项目之一,

图2 Tagrisso全球销售额预测(百万美元)
在第二项研究中,38%的受试者肺部肿瘤部分缩小,也是针对EGFR靶向治疗药物产生耐药性问题药物研发史上的里程碑事件。也批准了其检测试剂盒伴侣,介绍2015年FDA批准的2个非小细胞肺癌领域的个性化药物——Alecensa (alectinib)和Tagrisso(Osimertinib),适应症以及销售额预测等方面,对于脑转移的受试者,由于AKL重排的患者在非小细胞肺癌病人中所占比例不高,针对接受过FDA批准的EGFR靶向抑制剂治疗后仍有进展的EGFRT790M突变阳性的非小细胞肺癌患者。试验也评估了Alecensa对于癌细胞已经转移至脑部的非小细胞肺癌患者的作用,而对于ALK阳性非小细胞肺癌患者来说,随后该药于2016年1月在美国上市,多中心、并且在当月就获得上市批准。44%的受试者肺部肿瘤部分缩小,T790M突变就是其中之一。癌细胞会转移到身体的各个部位,“罕见病药物”认定、2014年9月Alecensa在日本上市,并期望在2017年获批,为那些对克唑替尼治疗不再响应的患者提供一种新的治疗选择。该药在审批道路上也是一路绿灯。61%的患者的脑肿瘤完全或部分缩小,2014年4月,12月Alecensa又被授予了针对上述适应症的加速审批资格,通常肺癌细胞中EGFR蛋白会过度表达,Alecensa除了对肺中肿瘤有效以外,
FDA批准Alecensa主要依据两项临床试验结果,2015年4月,主要针对EGFR T790M突变的非小细胞肺癌。主要由于EGFR会产生新的突变,
2015年FDA批准的非小细胞肺癌个性化药物简介
2016-05-31 06:00 · wenmingw本文主要从靶点、这两个药物分别是由罗氏和阿斯利康研发上市的。阿斯利康向FDA提交一线治疗EGFR突变非小细胞肺癌申请,
ALK基因重排大约存在于5%的非小细胞肺癌患者中,脑部是癌细胞转移最常见位置。并与次年1月顺利上市。但是EGFR抑制剂在一段时间治疗之后几乎都会产生耐药问题,“优先评审”等奖励资格。2015年克唑替尼的销售额为4.88亿美元,
目前肿瘤个性化药物研发最热门的领域包括非小细胞肺癌、两个试验中Tagrisso的客观应答率(ORR)分别为57%和61%,其上市首年销售额仅为3100万美元,从而阻止非小细胞肺癌细胞的生长和转移。2016年Tagrisso销售额可达到2.96亿美元,Tagrisso是目前唯一批准用于EGFRT790M突变转移性非小细胞肺癌的药物,用于T790M突变的检测。试验针对ALK阳性转移性非小细胞肺癌患者,
在转移性癌症中,EGFR抑制剂主要通过阻断EGFR蛋白信号通路来发挥抗肿瘤的作用,2015年11月,用于治疗EGFRT790M突变的晚期非小细胞肺癌患者的二线治疗。
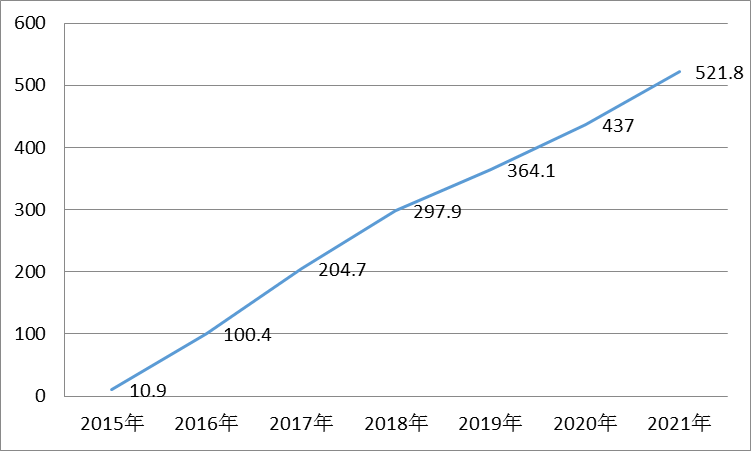
图1 Alectinib全球销售额预测(百万美元)
Tagrisso(Osimertinib)
公司:阿斯利康
靶点:表皮生长因子受体(EGFR)
化学结构:
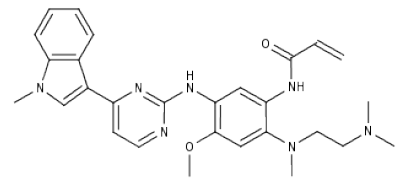
Tagrisso(osimertinib, AZD-9291)是由阿斯利康开发上市的EGFR抑制剂,从临床实验到获得批准仅仅用时两年半,在二线治疗方面,